기술정보
▣ 전도성 이중 코팅막 형성을 통한 Ni-rich 양극소재의 성능 향상
 |
 |
||
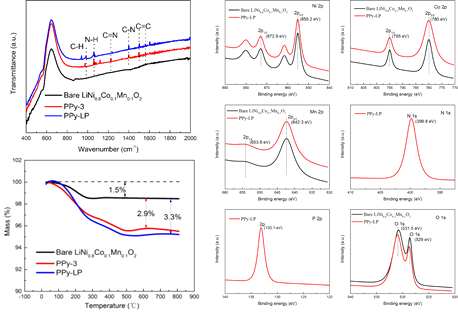
| Figure 2. FT-IR spectra of bare LiNi0.8Co0.1Mn0.1O2, PPy-3 and PPy-LP samples. Figure 3. XPS patterns of bare LiNi0.8Co0.1Mn0.1O2 and PPy-LP samples. Figure. S1. TG curves of the bare LiNi0.8Co0.1Mn0.1O2, PPy-3 and PPy-LP samples Figure 6. TEM images of (a) bare LiNi0.8Co0.1Mn0.1O2, (b) LP-2, (c) PPy-3, and (d) PPy-LP samples. |
|||
 |
 |
||
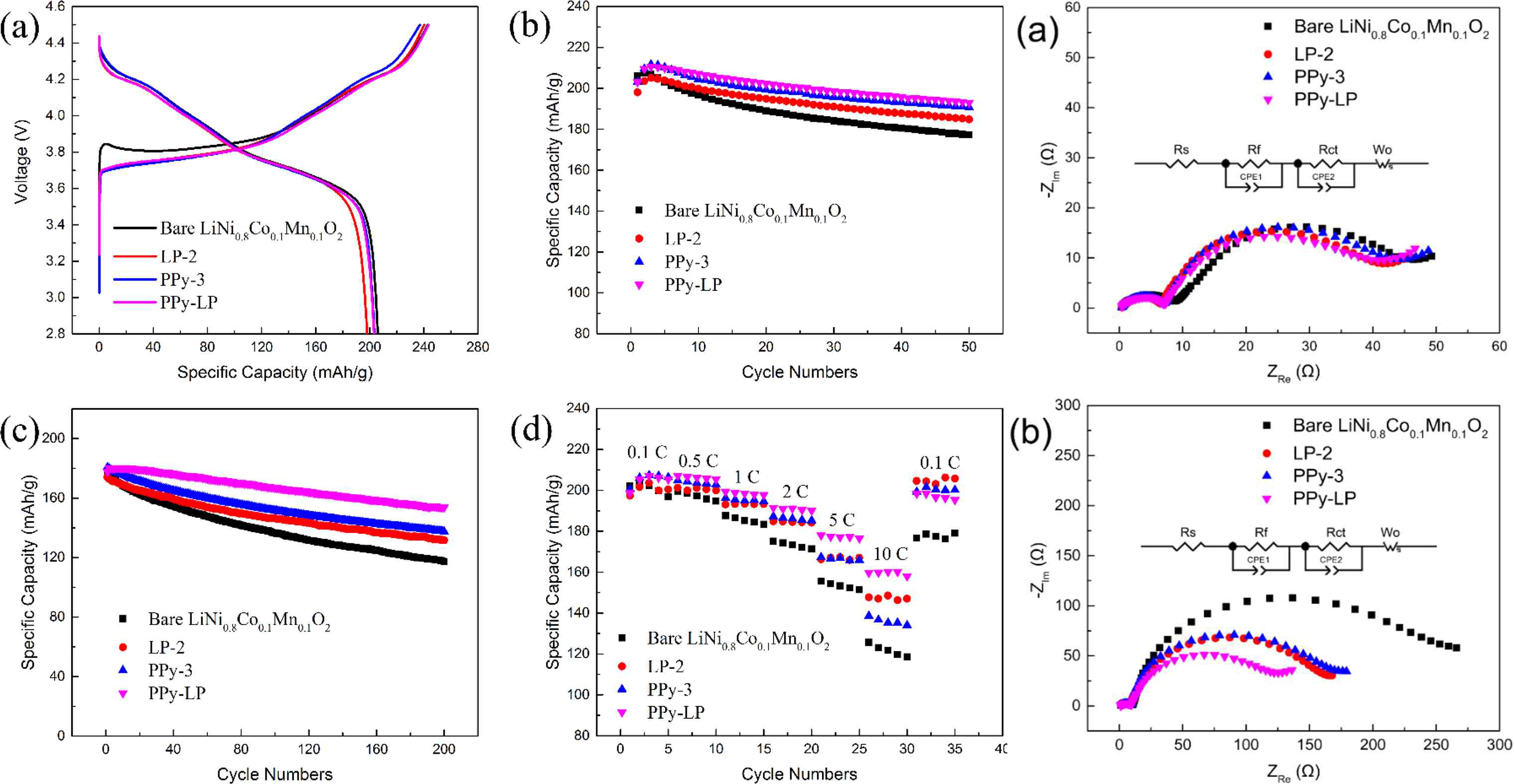
| Figure 7. (a) The initial charge and discharge curves, (b) cycling properties at 0.1 C, (c) cycling properties at 1 C, and (d) rate properties of bare LiNi0.8Co0.1Mn0.1O2, LP-2, PPy-3, and PPy-LP samples between 2.8 and 4.5 V at 25 °C. Figure 8. SEM images of cross section for the (a) bare LiNi0.8Co0.1Mn0.1O2, (b) LP-2, (c) PPy-3, and (d) PPy-LP cathode materials after 50 cycles. Figure 10. Nyquist plots of bare LiNi0.8Co0.1Mn0.1O2, LP-2, PPy-3, and PPy-LP samples after (a) 1st and (b)50th cycles; the inset is the equivalent circuit model. |
|||
- Title : Ni-Rich LiNi0.8Co0.1Mn0.1O2 Oxide Coated by Dual-Conductive Layers as HighPerformance Cathode Materials for Lithium-Ion Batteries (ACS Appl. Mater. interfaces, 2017, 9, 29732-29743) - Ni-rich 층상계 Li[Ni0.8Co0.1Mn0.1]O2 양극소재에 Li3PO4 와 PPy(poly pyrrole)의 이중 복합 표면개질을 구현하여 전도성 향상 및 균일한 코팅층 형성에 의해 구조 및 전기화학적 성능이 향상되는 내용의 논문이 ACS 저널에 소개되었다. - 표면개질법은 두 단계 과정을 거쳐 이루어졌다. 먼저 습식 코팅법을 통해 Li3PO4를 형성 (0.1wt% PVP + 2wt% (NH4)2HPO4의 에탄올 분산 용액 이용)한 후, 이어서 chemical oxidation polymerization 방법을 이용하여 PPy(doping agent: sodium p-toluenesulonate, oxidation agent: FeCl3를 이용, 저온중합)를 코팅시켰다. - SEM 및 TEM 이미지와 FT-IR 및 XPS를 통한 bonding 분석 및 TGA의 열중량 변화를 통해 Li3PO4 및 PPy 코팅층 형성을 확인하였으며, 4 point probe method를 이용하여 전기 전도성을 측정한 결과, PPy 함량이 높은 샘플일수록 전기전도성(최대 6,000배 가량) 우수한 결과를 나타내었다. - 표면개질에 따른 구조변화를 분석하기 위하여 XRD를 측정하였고, XRD pattern 상에서는 차이를 보이지 않았다. 다만 Li3PO4 표면개질의 경우 격자상수 c 값이 다소 증가하는 경향을 나타냈으며, 이는 500 oC (고온)에서 (NH4)2HPO4가 표면의 잔존리튬 뿐만 아닌 벌크 구조 내의 Li을 표면쪽으로 이동시키는 결과로 인해 c 축이 증가된 것으로 논문의 저자는 설명하고 있다. - 초기 충/방전 실험에서 표면개질 된 샘플의 가역용량 및 효율이 bare 대비 낮은 것에 대하여 표면개질 종들이 전기화학적으로 비활성인 것과, Li3PO4 형성 시의 리튬 손실 및 PPy 내로 리튬이온이 insertion 된다고 보고한다. - 수명특성과 율특성에서는 표면개질 된 샘플이 우수한 용량유지율을 나타내며, 이는 전도성이 우수한 표면개질 종이 전해액과의 부반응을 막아줌과 동시에 수명 진행 동안의 내부 균열 또한 막아주는 효과로 추정한다. - 추가로 진행한 EIS 분석을 통해 50 cycle 이후 표면개질 샘플의 Rct 저항이 감소하는 경향과 Warburg 영역 분석을 통해 구한 Li+의 확산계수 또한 높은 값을 나타내는 것을 결과를 통해 전기화학 특성의 우수성을 설명한다. |
|||
▣ 유리병 재활용을 통한 3D-Si분말 합성과 리튬이차전지에의 응용
 |
|||
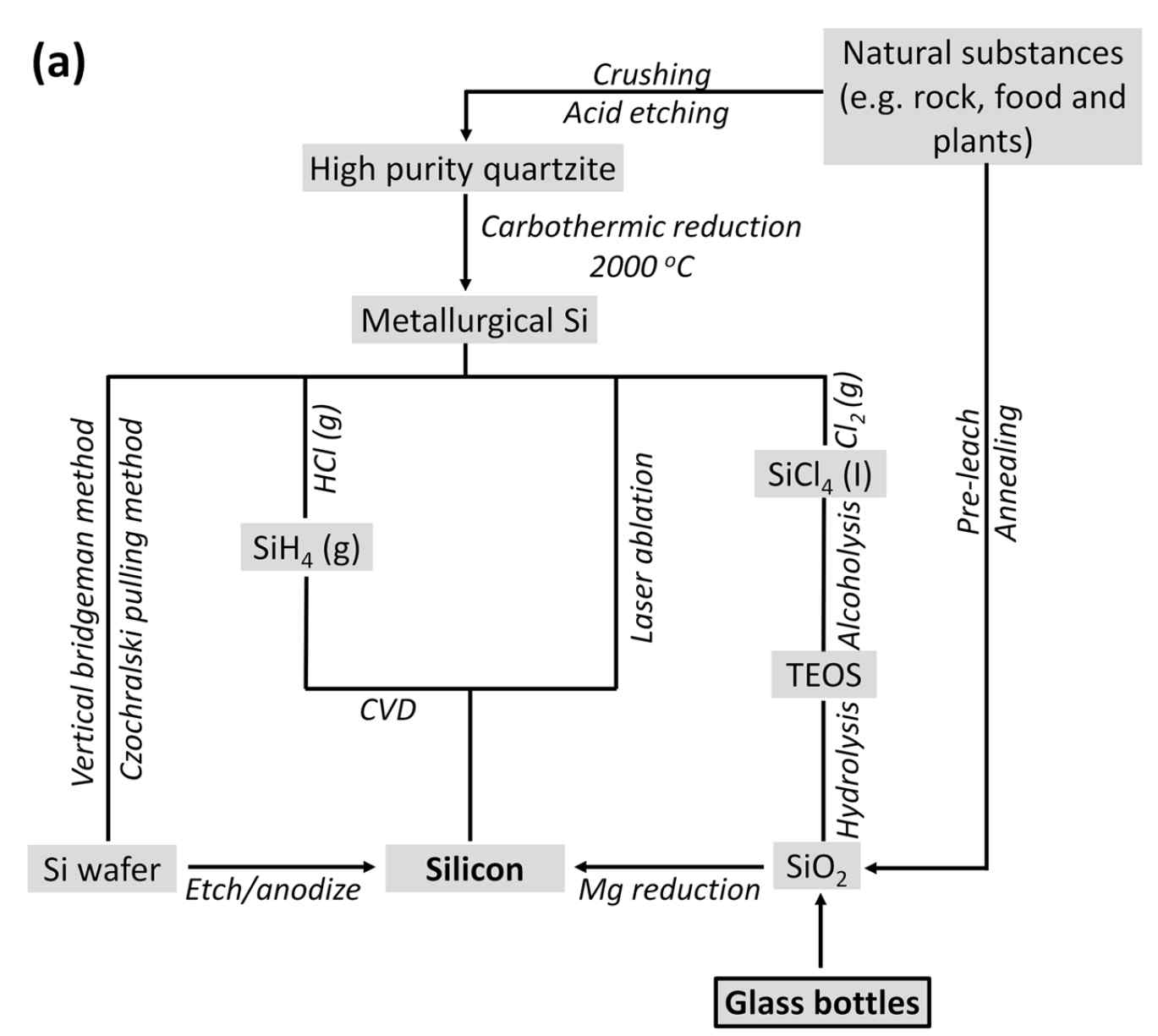
| Figure 1. Flow chart showing existing synthesis routes for nano-Si, including our synthesis method from glass bottles. | |||
 |
|||
| Figure 2. (a) Low magnification TEM image of gSi particles. (b) HRTEM image of gSi showing the characteristic lattice spacing of Si (111). (c) STEM-HAADF image of gSi and (d) EDS elemental map showing the high purity of reduced Si. | |||
 |
|||
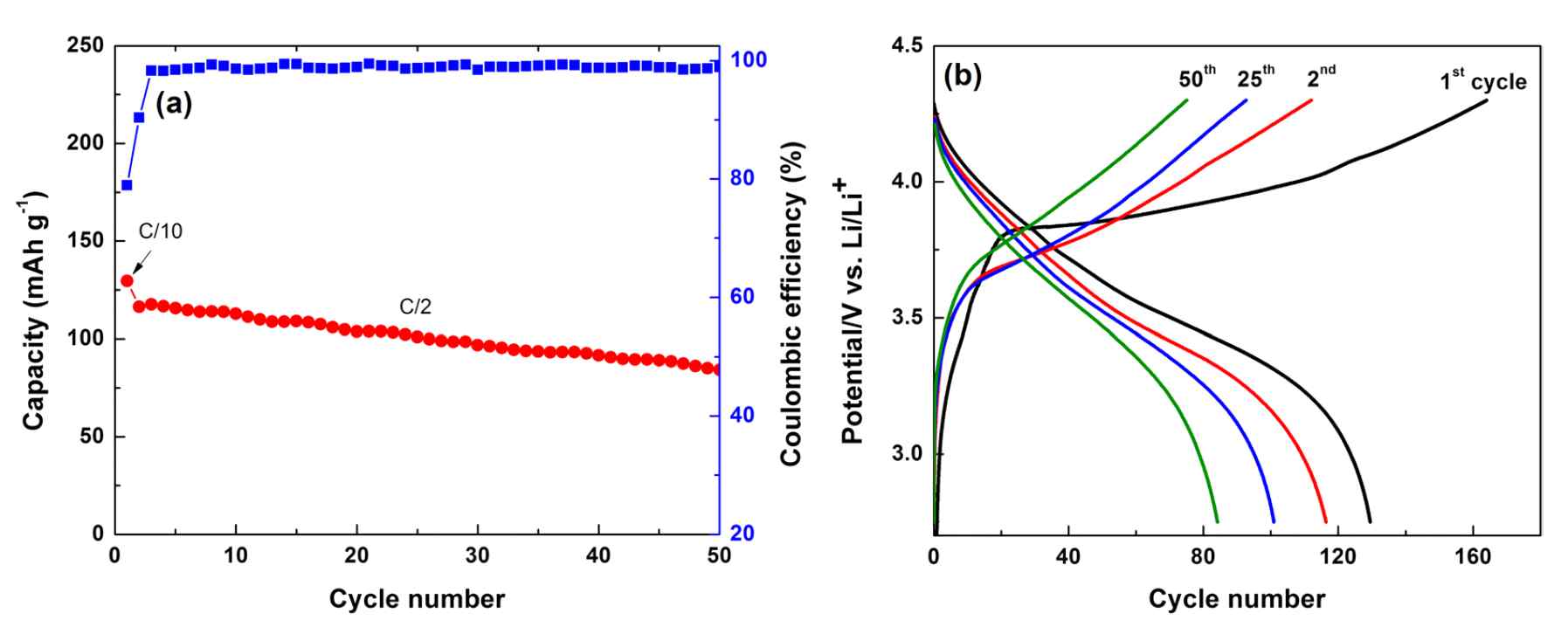
| Figure 3. (a) Cycling performance of full cells employing gSi@C anode and LiCoO2 cathode for 50 cycles. (b) The corresponding galvanostatic charge-discharge curves of the full cells. |
|||
- Title: Silicon Derived from Glass Bottles as Anode Materials for Lithium Ion Full Cell Batteries - 미국 University of Califonia Riverside 연구팀은 버려지는 유리병으로부터 Si nanoparticle에서 microparticle까지 얻을 수 있는 공정을 제시하였다. 기존의 CVD를 통한 pyrolysis공법이나 다양한 나노구조의 합성에는 많은 비용, 고에너지 소모 등으로 인한 대량생산에는 부적합함을 주장하면서 이와 비교하여 우리 주변에서 재활용을 하고 있음에도 불구하고 많이 버려지는 유리병을 이용해 리튬이온전지에 활용할 수 있는 3-D Si입자 제조 공정을 제시하고 있다. (Figure 1). - 유리병의 주 성분인 SiO2로부터 Si 입자를 얻는데 NaCl과 Mg를 이용하였다. Mg는 SiO2의 환원제로써의 역할을 하며 NaCl은 SiO2의 O가 Mg와 결합하는 과정에서 glass quartz powder간의 cross-link를 형성한다고 주장하고 있다. 지속적으로 발생하는 열은 또다시 Si의 합성을 야기하며 본래의 형태를 파괴하고 입자뭉침을 일으키지만, 이때 NaCl이 SiO2입자를 둘러싸면서 heat scavenger처럼 거동하여 self-fusion에 사용될 대량의 열을 흡수한다고 주장한다. 또한 NaCl은 가격이 저렴하고 독성이 없고 쉽게 재사용까지 가능하여 이 공정에 적합한 재료임을 제시하고 있다. Si과 Mg의 부반응에 의한 잔여물을 etching하는 과정에서 3D network를 형성하는 Si구조를 얻을 수 있음을 투과전자현미경(TEM) 이미지를 통해 제시하였다. (Figure 2) - 리튬이차전지에 사용가능함을 보여주기 위해 As-made 3D-Si구조와 이를 섭씨 900도씨에서 Stylene gas를 이용해 Carbon coating을 진행한 두 음극재를 전지평가에 이용하였으며 그 데이터를 도표로 제시하고 있고 또한 LiCoO2 양극과 함께 Full cell test도 함께 진행하고 그 결과를 마찬가지로 도표 3에 제시하여 차세대 음극재료로 활발히 연구되고 있는 Si에 대하여 Eco-friendly, Energysaving한 공정을 제시하고 있다. (Figure 3) 자료출처: Scientific Reports, 7, 917, (2017), DOI:10.1038/s41598-017-01086-8 |
|||

